堀居拓郎1*,森田純代1,日野信次朗2,日野裕子2,福嶋悠人3,小林良祐1,木村美香1,中尾光善2,水上洋一4,井上梓3,5,畑田出穂1,6*(1. 群馬大学・生体調節研究所・生体情報ゲノムリソースセンター・ゲノム科学リソース分野,2. 熊本大学・発生医学研究所・細胞医学分野,3. 理化学研究所生命医科学研究センター・疾患エピゲノム遺伝研究チーム,4. 山口大学大学研究推進機構 ・総合科学実験センター・遺伝子実験施設 , 5. 東京都立大学, 6. 群馬大学未来先端研究機構・ウイルスベクター開発研究センター, *責任著者)
About
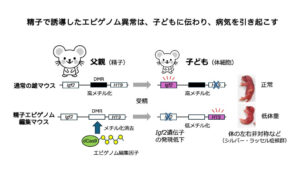
従来、親の特徴はゲノムDNAの塩基配列によって子に受け継がれると考えられてきましたが、近年、親へのストレスが配偶子のエピゲノムに影響し、子や孫に体質や病気をもたらす可能性が示されています。しかし、エピゲノムの変化が直接受け継がれるのか、別の要因が関与するのかは不明でした。
本研究では、精子特異的にDNAメチル化を消去する「精子特異的エピゲノム編集システム」を開発し、マウスで検証しました。標的領域H19-DMRはシルバー・ラッセル症候群で異常が報告されている部位で、通常精子では高メチル化状態ですが、本システムにより大きく低下させることに成功しました。その結果、精子で低下したメチル化状態の一部が子に受け継がれ、低体重や体の左右差などシルバー・ラッセル症候群に似た特徴が現れました。一方、異常の全てが受け継がれるわけではなく、受精後に一部が回復する安全機構が存在し、その回復にはヒストン修飾H3K9me3が関与することも判明しました。
本研究は、DNA配列以外の変化が子に伝わり病気発症に関与することを世界で初めて直接示しました。今後は発症メカニズムの解明や予防・治療法開発への応用が期待されます。
Paper information
Horii T, Morita S, Hino S, Hino Y, Fukushima H, Kobayashi R, Kimura M, Nakao M, Mizukami Y, Inoue A, Hatada I. Germline epigenome editing identifies H3K9me3 as a mediator of intergenerational DNA methylation recovery in mice.
Nat Commun. 2025 Dec.
Online URL
https://www.doi.org/10.1038/s41467-025-67488-9