メンバー紹介
 |
氏名 | 泉 哲郎 IZUMI TETSURO |
|---|---|---|
| 所属 | 群馬大学生体調節研究所・教授 | |
| ラボURL | http://imcr.showa.gunma-u.ac.jp/lab/geneeng/index.html |
研究内容
本分野は、内分泌代謝疾患、特に糖尿病の病態生理・成因を分子・細胞レベルで解明することをテーマとして、主に以下の2つの研究を行ってきた。
1)分泌顆粒の開口放出機構、特に膵β細胞におけるインスリン分泌機構
我々が発見した、膵β細胞に特異的に高発現するgranuphilinという分子は、分泌顆粒膜上の低分子量GTPase Rab27aと細胞膜上の膜融合装置syntaxin-1aを連結して、分泌顆粒膜を細胞膜にドッキングさせる。この知見は、分泌顆粒ドッキングの分子基盤をはじめて明らかにしたのみならず、分泌小胞の定常的な細胞膜ドッキングは次の膜融合反応に必須の過程ではなく、むしろこれを一時的に抑制する過程である、という調節性分泌経路の根幹に関わる新説を提唱した。現在、この仮説を証明するために、分子間相互作用の生化学的解析、細胞膜近傍の顆粒動態を観察する全反射顕微鏡解析などを行っている。またgranuphilinのRab27a結合領域と類似した一次配列を持つexophilin4は、膵α細胞グルカゴン分泌顆粒のドッキングに関わり、分泌細胞間で分泌小胞ドッキングの分子機構が分化していることの生物学的意義を探求中である。このように多細胞生物で高度に分化する調節性分泌経路におけるRab27とそのエフェクター分子の機能解析を通して、分泌過程の分子基盤構築をめざしている。
2)疾患モデルマウスを用いた、糖尿病・肥満の成因や病態生理
常染色体優性遺伝形式を示す自然発症糖尿病モデルAkitaマウスの原因が、インスリン2遺伝子の一方のアリルのシステイン残基の変異によることを発見した。変異プロインスリンは、分子内ジスルフィド結合形成不全による折りたたみ(folding)異常のために、小胞体からゴルジ装置以降に転送されなくなる。本知見は、遺伝学的に初めて非肥満性糖尿病モデルマウスの原因遺伝子を明らかにしたのみならず、糖鎖を持たない可溶性蛋白質の立体構造異常が疾患を引き起こすことを示した、最初の報告例である。また近年盛んな、糖尿病における膵β細胞小胞体ストレスの重要性に関する研究の先鞭をつけた。さらに多因子遺伝性糖尿病・肥満モデルTSODマウスの遺伝学的解析を行い、血糖値・体重などに影響する量的形質遺伝子座を同定した。現在、その局在領域を狭め、遺伝子実体の解明をめざしている。
図1.膵β細胞の電子顕微鏡写真
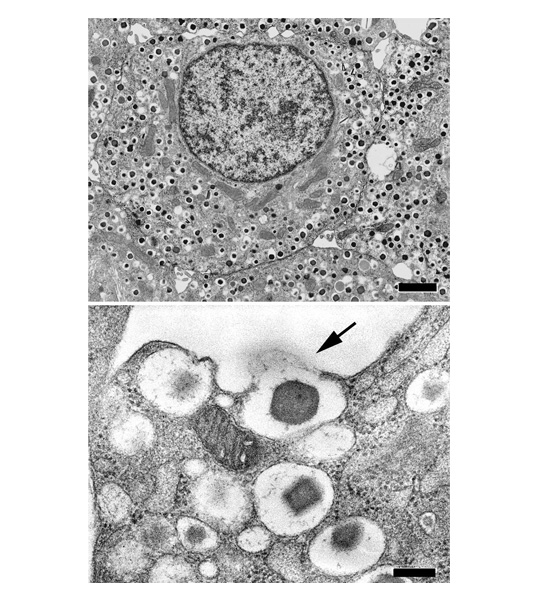
図2.Rab27エフェクターとして機能する多様な分子
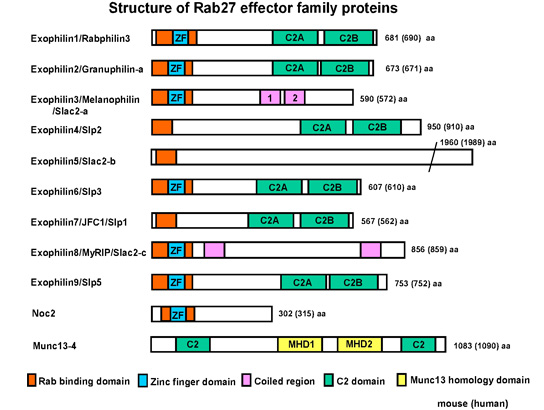
図3.私たちが研究しているマウス

