メンバー紹介
 |
氏名 | 平井 宏和 HIRAI HIROKAZU |
|---|---|---|
| 所属 | 群馬大学大学院医学系研究科・教授 | |
| ラボURL | http://synapse.dept.med.gunma-u.ac.jp/index.html |
研究内容
小脳は歩いたり、文字を書いたりするなど、筋肉を用いるあらゆる動きをスムーズに行うのに大変重要な役割を担っている。また自転車に乗れるようになるなど、運動学習にも不可欠な器官である。小脳の大部分は生後になって形成される。小脳顆粒細胞の前駆細胞は、生後2週目に至るまで小脳の表面に存在し活発に分裂する。同時に、多くの顆粒細胞前駆細胞は分裂を停止し、プルキンエ細胞層の下層(将来の顆粒細胞層)へと遊走を開始する。プルキンエ細胞は生後に樹状突起を伸ばしはじめ、その過程で遊走中の下流細胞の軸索(平行線維)との間に興奮性シナプスを形成する。
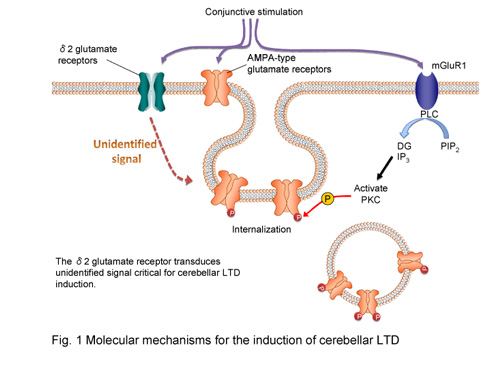
プルキンエ細胞は延髄の下オリーブ核からもう一つの興奮性入力を受ける。下オリーブ核からプルキンエ細胞へ向かう神経細胞軸索は登上線維と呼ばれており、生直後には5〜6本の登上線維が一つのプルキンエ細胞にシナプスを形成する。その後、不要な登上線維は除去され、生後4週目までに機能的に重要な1本のみが残る。このような顆粒細胞の分裂制御/遊走、プルキンエ細胞の樹状突起伸長、平行線維シナプス形成、登上線維シナプス除去には多くの分子が関与していることが報告され、その一端は解明されつつあるが、まだまだ多くのことが不明である。我々は小脳皮質の発達、及びシナプス可塑性の分子メカニズム(Fig.1)を明らかにすることを主要課題の一つとしており、この目的のためにレンチウイルスベクターを用いた発達期小脳細胞への選択的外来遺伝子発現法を開発し、その技術を駆使して研究を行っている。
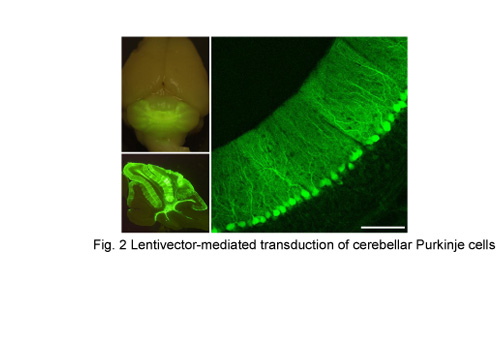
もう一つの研究テーマは、神経変性疾患の一つである遺伝性の脊髄小脳変性症(SCA)の病態解明と治療法開発である。SCAは現在根治につながる治療法が見つかっていないが、近年、原因遺伝子が発見されその病態解明も大きく進んでいる。我々はSCAのモデルマウスを作出し、ウイルスベクターを用いて治療効果があると考えられる遺伝子を発現(Fig.2)させることで症状を改善させる研究を行っている。In vivoで運動失調の改善を指標としており、実際に患者の治療につながることを目標に研究を進めている。